
Ovinos
Realizado por MVZ. Hugo López
Correo para correspondencia: contacto@biozoo.com.mx
Las parasitosis gastrointestinales se pueden considerar como uno de los problemas sanitarios más importantes en los sistemas de producción ovinos a nivel mundial, afectando la salud de los animales, manifestándose por diarrea, perdida de apetito, anemias (dependiendo la infestación es la severidad de esta) lo que puede producir la muerte de los ovinos.
Existen infestaciones subclínicas las cuales son infecciones leves pero persistentes, este tipo de infestación tiene impacto económico en las explotaciones, ya que los animales tienden a disminuir sus parámetros productivos (carne, leche, calidad de lana, reproducción) así como incrementar los costos que se generan para el mantenimiento de los ovinos.
Las especies predominantes de parásitos gastrointestinales son fundamentalmente Haemonchus contortus, Trichostrongylus colubriformis y Trichostrongylus axei, Ostertagia y Fasciola hepática.
La presencia de estos parásitos depende en gran medida del manejo de los animales en cada una de sus etapas productivas.

Raza Dorper
En animales jóvenes las infestaciones más comunes son por protozoarios tales como Cryptosporidium y Eimeria spp. En ambos casos, los corderos se infectan al ingerir los ooquistes esporulados que fueron eliminados por otros animales en las heces.
Cryptosporidium afecta principalmente a corderos menores de dos semanas, mientras que las infecciones por Eimeria se manifiestan fundamentalmente a partir de la tercera semana. Ambos parásitos generan problemas digestivos caracterizados por la presencia de diarrea (color amarillento de consistencia pastosa o liquida para Cryptosporidium y de aspecto mucoso o sanguinolento para el caso de Eimeria spp.
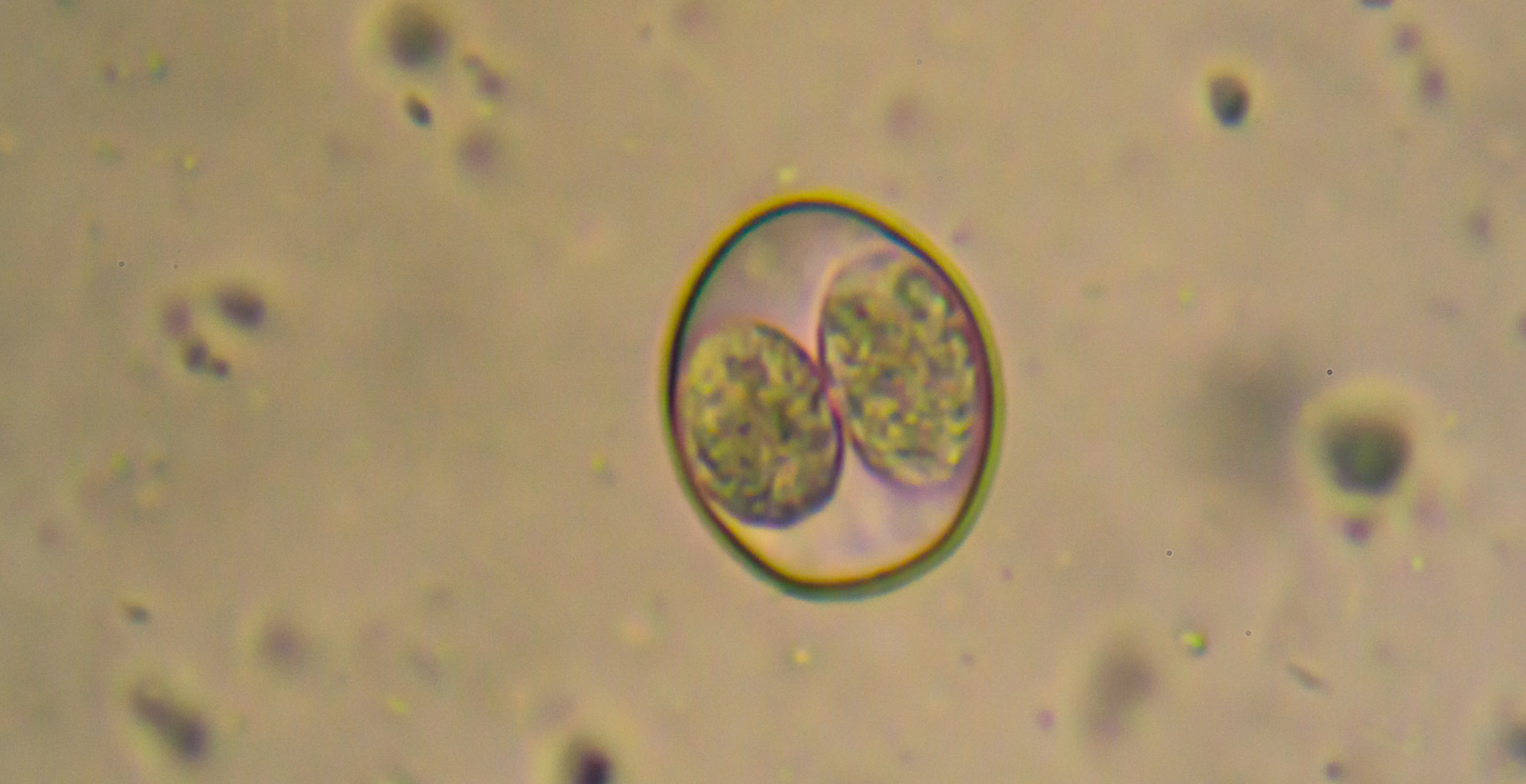
Oocisto Esporulado De Eimeria
Los corderos pueden presentar apatía , disminución del apetito y perdida de peso, cuando la carga parasitaria es alta y el animal se encuentra deshidratado puede ocurrir la muerte del animal.
Entre los parásitos que afectan con mayor frecuencia a los ovinos adultos destacan los helmintos: nematodos, cestodos y trematodos.
Los animales se infectan al ingerir las fases infectantes que se encuentran libres o dentro de organismos que actúan como hospederos intermediarios. La ingestión de larvas 3 que contaminan el pasto pueden dar lugar a las llamadas “gastroenteritis parasitarias” las cuales se caracterizan por la aparición de distintos cuadros clínicos en función del parasito; así enfocaremos la información sobre Haemonchus contortus y Fasciola hepática.
Este parasito destaca por su amplia distribución y por su alta patogenicidad. Entre los efectos que produce destacan la anemia, la hipoproteinemia y el retraso en el crecimiento, llegando a provocar en ocasiones la muerte en animales jóvenes fuertemente parasitados.
Es un nematodo perteneciente al Orden Strongylida, Superfamilia Trichostrongyloidea, el cual se aloja en el abomaso de los pequeños rumiantes (es conocido como el gusano del cuajo).
Los machos miden entre 10 y 20 mm y son de color rojizo, las hembras miden entre 18 y 30 mm y su coloración se alternan el rojo y blanco, debido a que el aparato digestivo, rojizo por la ingesta de sangre, se enrolla en espiral alrededor del reproductor, blanquecino.
La bolsa copuladora del macho tiene lóbulos laterales alargados sustentados por radios largos y finos, mientras que el lóbulo dorsal está desviado hacia un lado, sustentado por un radio, muy característico, en forma de Y. Las espículas miden entre 0,46 y 0,51 mm, y presentan un pequeño repliegue en el extremo.
Ambos cuentan con una cápsula bucal pequeña que posee una lanceta. Las papilas cervicales son prominentes. La vulva suele estar protegida por una solapa o lengüeta. Los huevos, de morfología típicamente estrongiloide, miden 70-85 x 41-48 μm, y salen con las heces del hospedador conteniendo una mórula de 16-32 blastómeros.
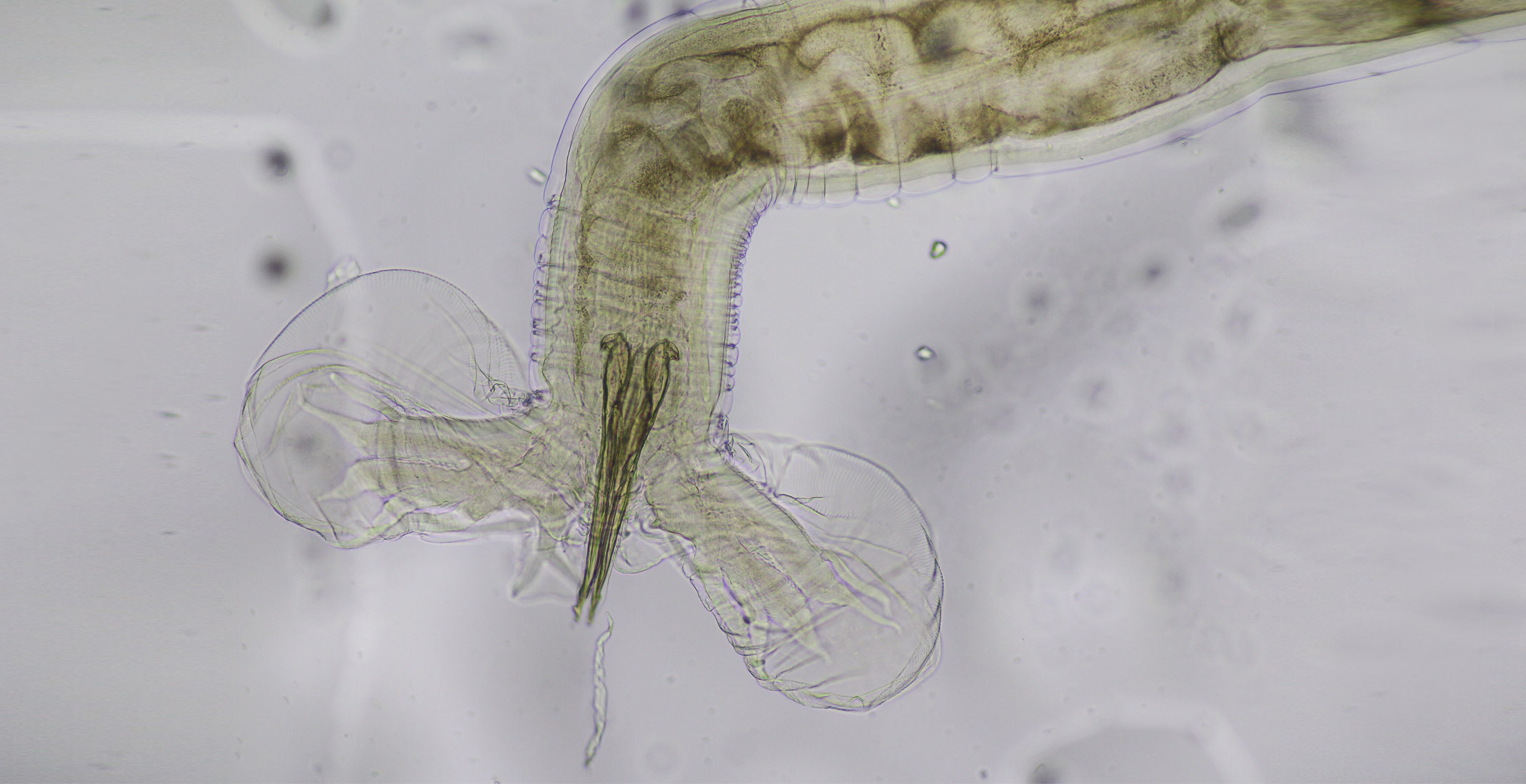
Haemonchus Contortus Bajo El Microscopio
El ciclo biológico de H. Contortus es directo, y no difiere del de otros tricostrongílidos. Los huevos que son eliminados con las heces eclosionan y la larva 1 (L1) muda a larva 2 (L2) en 1 a 2 días. Estas dos primeras fases se llevan a cabo en las heces donde el parasito permanece, alimentándose de materia orgánica y microorganismos presentes en la misma. La L 2 muda hasta el estadio infectante 3 (L3), conservando la cutícula del estadio anterior la cual cubre completamente la larva en modo de vaina, con la función de aislarla del medio externo. Este estadio larvario (larva 3) migra hacia la hierba cuando las condiciones de humedad son las adecuadas. El tiempo transcurrido entre la salida al exterior del huevo y la aparición de las primeras larvas infectantes va de los 5 a 6 días, aunque el desarrollo puede retrasarse (inclusive meses) si la temperatura y las condiciones de humedad no son las óptimas.
Las L3 son ingeridas con el pasto o hierba por el hospedador, comenzando así su ciclo parasitario. En el rumen se liberan de la vaina que las envuelve y estas se introducen en las glándulas epiteliales de la mucosa abomasal (preferentemente en la región del fundus) para continuar su desarrollo. Las larvas 4 (L4) aparecen en la superficie de la mucosa a los 4-5 días de la ingesta (contagio) y tras una nueva muda se convierten en larva 5 (L5) o preadulto, los cuales maduran sexualmente para dar lugar a las larvas adultas, las cuales copulan y comienzan con la producción de huevos. El periodo de prepatencia oscila entre 15 días y 21 días, a menos que se lleve a cabo un proceso de hipobiosis (el fenómeno de hipobiosis consiste en la permanencia durante varios meses de las L4 en la mucosa en un estado de latencia, generalmente coincidiendo con situaciones ambientales adversas)
Ciclo Biológico De Haemonchus Contortus
La infección por nematodos de la familia Trichostrongylidae produce en los pequeños rumiantes el denominado síndrome de gastroenteritis parasitaria. Tanto los estadios larvarios L4 y L5 como los adultos se caracterizan por su carácter hematófago, siendo la anemia el principal efecto patógeno del parásito. Los vermes adultos, de mayor tamaño, ingieren más cantidad de sangre, con lo que son los principales responsables de los cuadros clínicos. Se calcula que un adulto puede ingerir 0,05 ml de sangre al día, con lo que un rumiante infestado con 5000 vermes tendría una pérdida diaria mínima de sangre de 250 ml.
La anemia es, por tanto, el principal signo clínico de la presencia de H. contortus. En una primera fase, a partir de la segunda semana de infección, se produce una caída brusca del hematocrito, en un momento en que la ingesta de sangre por el parásito todavía no puede ser compensada por el incremento de la eritropoyesis. Cuando ésta aumenta, se estabiliza el hematocrito (6-14 semanas post-infección). Sin embargo, la pérdida continua de hierro hace inviable mantener la hematopoyesis, con lo que vuelve a descender el hematocrito, esta vez a niveles en los que puede llegar a provocar la muerte del animal.
La anemia hemorrágica que sufre el animal supone una pérdida severa de proteínas que el hígado intenta compensar incrementando la síntesis de albúmina. Sin embargo, el progresivo agotamiento de las reservas metabólicas del animal genera finalmente hipoproteinemia, desencadenando extravasación de líquido y, consecuentemente, edemas.
Se ha demostrado un aumento del pH durante la infección por L3 como consecuencia de una alteración de la permeabilidad del epitelio, se produce la modificación de la Diferencia de Potencial Transmural (DPT), que se define como el potencial eléctrico a ambos lados de la pared digestiva, con un aumento de iones HCO3 - en la luz, lo que eleva el pH. Este hecho dificulta la transformación del pepsinógeno en pepsina, alterándose la digestión de las proteínas en su primera fase, y agravándose con ello el déficit proteico. Además, la subida de pH reduce sensiblemente el poder bactericida de la microflora ruminal, lo que afecta el estado nutricional del animal, puesto que la proteína microbiana es una fuente importante de nitrógeno.
Otro efecto patógeno asociado a la presencia del parásito adulto en el abomaso es un aumento en los niveles séricos de gastrina y pepsinógeno, así como en la secreción de gastrina.
Finalmente, la anorexia aparece como una consecuencia directa de la parasitación.
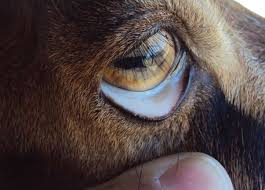
Mucosas Pálidas Por Anemia En Ovinos
La parasitación por H. contortus provoca dos tipos de cuadro clínico, agudo y crónico, en función de factores relacionados con el hospedador, el parásito y las condiciones ambientales.
El cuadro agudo se presenta habitualmente en animales jóvenes muy parasitados. La anemia aparece a partir de la segunda semana de infección, estabilizándose entonces el hematocrito gracias a la actividad hematopoyética de la médula ósea. Sin embargo, la pérdida continua de proteínas y hierro produce finalmente un agotamiento de la médula ósea, que al final es incapaz de reponer eficazmente las células perdidas. Con ello se agrava el proceso, que puede desencadenar la muerte del animal.
Los síntomas principales son la palidez de mucosas, edema (especialmente submandibular y abdominal), letargia, presencia de heces oscuras y caída de la lana. La diarrea no suele ir asociada a este proceso, a diferencia de los causados por otros miembros de la familia Trichostrongylidae. En las hembras se produce agalactia y el análisis sanguíneo muestra anemia e hipoalbuminemia.
Las canales aparecen pálidas y con edema acumulado en las zonas indicadas anteriormente. En el interior del abomaso se puede observar abundante líquido edematoso rojizo, y vermes de color también rojizo sobre la mucosa, en la que se aprecian numerosas petequias y erosiones.
En los cuadros hiperagudos, producidos por infecciones masivas, pueden llegar a darse casos de muerte súbita de animales aparentemente sanos, incluso en el periodo de prepatencia, como consecuencia de una gastritis hemorrágica severa. En la necropsia se puede observar inflamación de la mucosa abomasal, que presenta un color rojizo, con abundantes vermes (maduros y/o inmaduros) y sangre en la cavidad gástrica.
El cuadro crónico se produce en animales con una carga parasitaria baja, de algunos cientos de vermes, en condiciones de alimentación deficiente debida, a una prolongada estación seca que limite la disponibilidad de pasto. La morbilidad es muy alta, en torno al 100%, y la mortalidad, escasa. Los recuentos fecales no llegan a superar los 2000 huevos por gramo (hgh).
La continua pérdida de sangre en esta situación repercute en el metabolismo, produciendo pérdida de peso, debilidad e inapetencia. No se suelen observar manifestaciones de la anemia ni edemas. Las lesiones son poco evidentes; la canal puede mostrar diversos grados de emaciación, observándose los vermes en el interior del abomaso y gastritis hiperplásica.
El tratamiento y control de las infecciones por nematodos gastrointestinales se ha basado en el uso de fármacos antihelmínticos, en combinación con determinadas medidas de manejo en el pastoreo que reduzcan el riesgo de infección.
El objetivo del tratamiento y control mediante fármacos es eliminar las dos fuentes principales de contaminación del pasto: los huevos eliminados en periparto y las larvas que han sobrevivido. Los fármacos más utilizados son los benzimidazoles y probenzimidazoles, los imidazotiazoles y las avermectinas.
La Fasciola hepática es un parásito que pertenece a la clase de los trematodos. El parásito adulto se aloja en el hígado y conductos biliares de los animales, cada parásito adulto puede llegar a producir entre 20.000 a 50.000 huevos por día, los cuales son llevados a través de la bilis al intestino, para su posterior excreción en las heces y una vez que llegan a alcanzar el agua, inician su ciclo biológico a partir de la formación de la primera fase larvaria llamada miracidio.
El pasto contaminado es su principal medio de transmisión y para que el trematodo pueda afectar a los animales debe generar un ciclo, donde, es necesario la intervención de un hospedador intermediario perteneciente a la familia de los caracoles dulceacuícolas Lymnaeidae y de un hospedador definitivo como los ovinos y caprinos.
La presencia de fasciolasis afecta de manera económica a la producción de carne, lana y leche. También representa un riesgo para el ser humano ya que es considerada zoonosis.
Es un helminto de un cuerpo ancho y aplanado dorso ventralmente de forma foliácea (forma de hoja), toma un color café, rosa o gris cuando se lo expone al formol; se encuentra recubierto por espinas alrededor de su cuerpo, con una medida de 18-51 mm de largo por 4-13 mm de ancho, está conformado de dos ventosas continuas, una ventral más grande que la oral y en su extremo craneal un estructura cónica (boca), cerca de esta estructura el aparato digestivo se divide en ramas primarias y secundarias, por debajo del poro ventral se encuentra el poro genital, posee una bolsa de órganos reproductores en su interior, en los que se encuentran representados ambos sexos, posee dos testículos y un ovario, siendo un parásito hermafrodita, convergen al poro genital ambos aparatos reproductivos. El tegumento de la F. hepática posee placas espinosas extendiéndose hacia el tejido muscular que se encuentra subyacente y comunicándose hacia la superficie por unos estrechos canales llevando el nombre de pericariones por llevar en su interior núcleos.
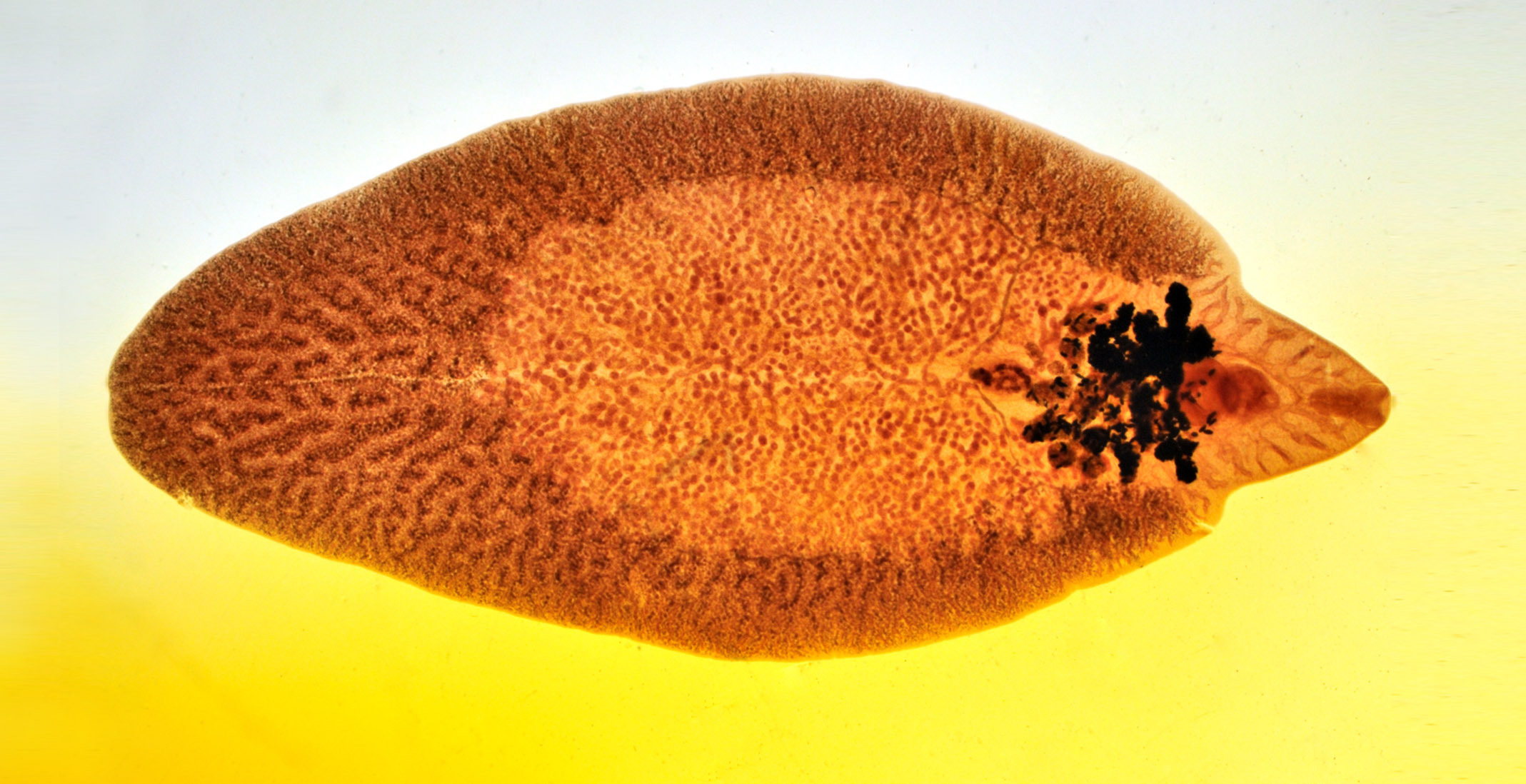
Fasciola Hepática
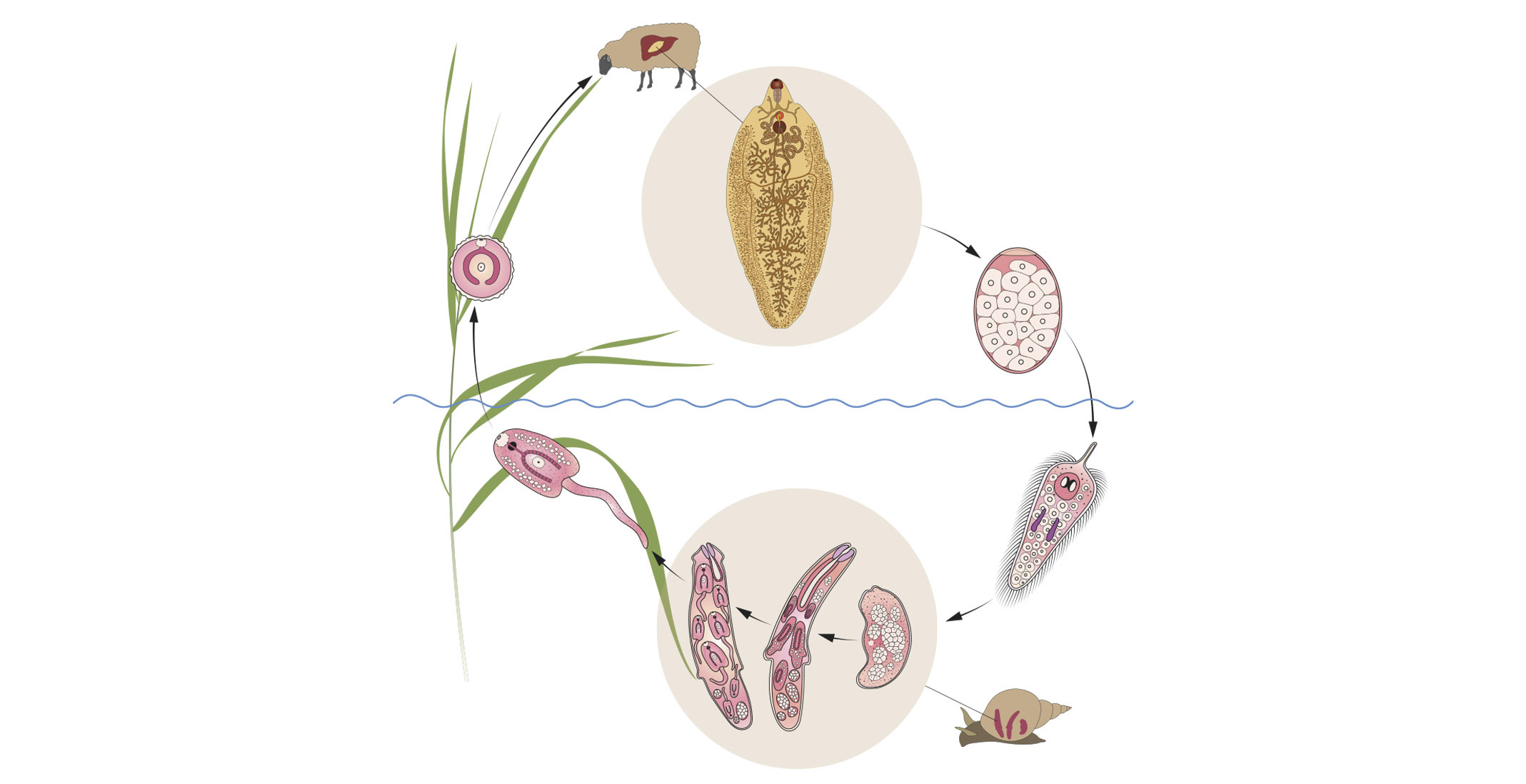
La F. hepática cumple un ciclo biológico heterogéneo, para ello necesita la intervención de un hospedador intermediario como el caracol del género Lymnaea y uno definitivo que vendría a ser el animal infectado que puede ser rumiante u otro mamífero.
Este parásito posee una capacidad de adaptación a diversas regiones y climas, lo que le permite desarrollarse en sitios húmedos especialmente en charcos y pantanos, esto permite que el ciclo de vida del parásito alcance su desarrollo en temperaturas óptimas dentro del rango entre 10 y 30 ºC.
El ciclo comienza cuando el animal infectado o el hospedador definitivo expulsa las heces con los huevos de la F. hepática, estos huevo cuentan en su interior con un ovocito fecundado, dentro de una cápsula operculada y al tener las condiciones de humedad se formará dentro de los huevos una fase larvaria ciliada interna llamada miracidio, que nada libremente para invadir e introducirse en el caracol (huésped intermediario) a través de su papila cónica en el extremo proximal, si no ingresa al hospedador en un lapso de 24 h la fase larvaria agota sus reservas energéticas y muere. En el interior de éste evoluciona a fase de cercaría, parecida a un renacuajo, que desarrolla una cola útil para su movilización y se desarrolla por completo en un tiempo aproximado de uno a dos meses, ayudado de temperaturas cálidas óptimas para su desarrollo.
Una vez culminado su desarrollo abandona el caracol y nada a distancias cortas para adherirse a alguna planta, perdiendo posteriormente su cola y transformándose así en la fase larvaria denominada metacercaria, que es la etapa final del parásito hasta que sea ingerido por el animal.
Una vez que los hospedadores definitivos ingieren el forraje o aguas infectadas con metacercaria, inicia un nuevo ciclo en el tubo digestivo y al estar en contacto con el jugo gástrico, el ácido permite que la membrana o envoltura que rodea a la metacercaria se disuelva dejando en libertad a la larva joven o fasciola juvenil. En esta nueva etapa, el parásito atraviesa la pared intestinal hasta alojarse en la cavidad abdominal, posteriormente el peritoneo y a la cápsula de Glisson, para más tarde penetrar en el hígado en donde migra por el parénquima durante cinco a seis semanas, transcurrido este tiempo se instalan finalmente en los conductos biliares donde alcanzan un estado adulto en un tiempo aproximado de tres meses, para finalmente iniciar el proceso de oviposición, los cuales son evacuados junto con las heces al medio externo propagando la infección e iniciando un nuevo ciclo del parásito.
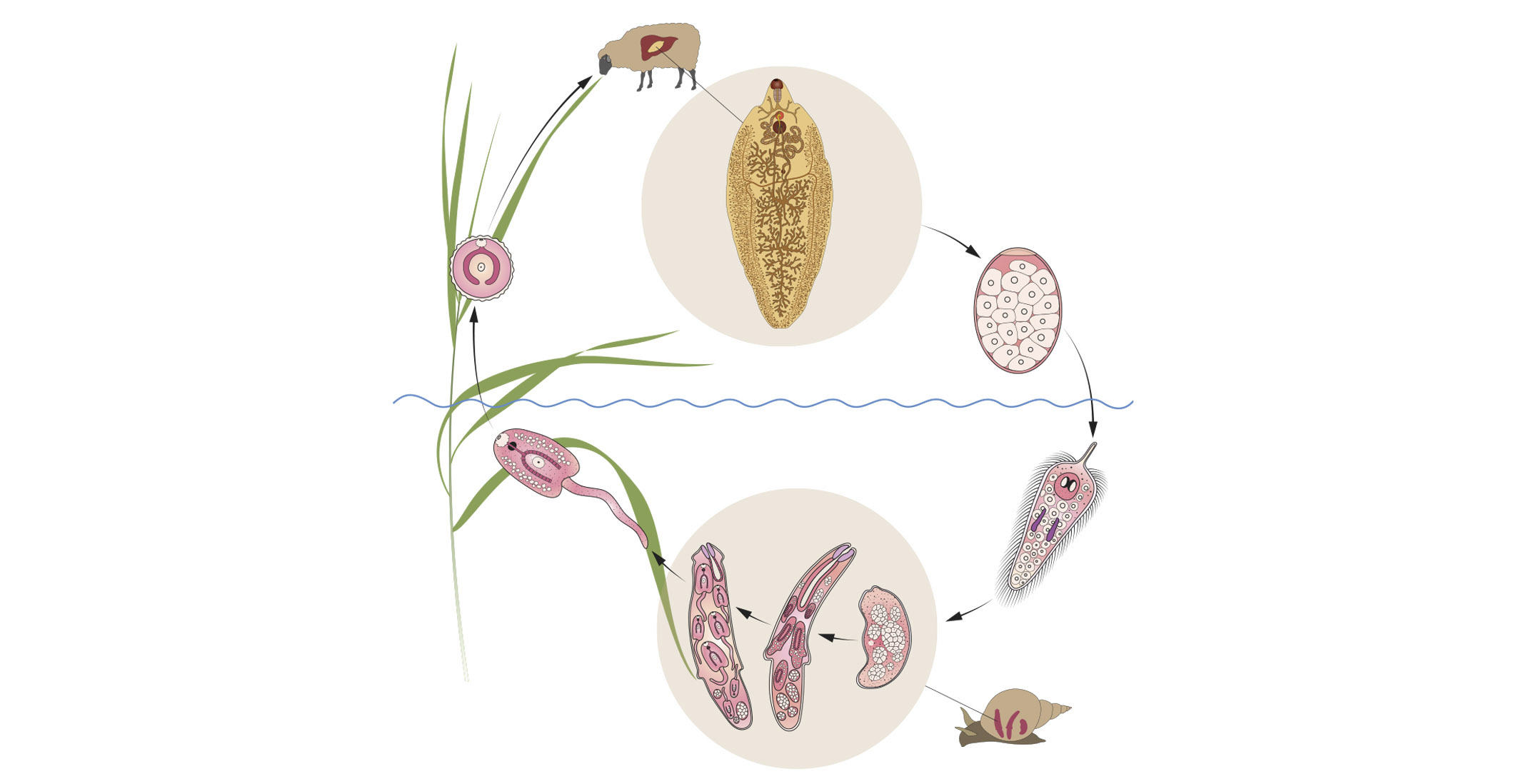
Ciclo Biológico De Fasciola Hepática
Las lesiones se pueden describir en base a lesiones anatomo e histopatológicas desarrolladas en los lóbulos hepáticos, que presentan un aumento de consistencia, engrosamiento de los ductos hepáticos con presencia de calcificación, material mucoso y formas adultas del parásito.
En el análisis postmorten, la fasciola queda viva en el hígado, logra una coloración muy oscura de tacto arenoso donde el tejido se vuelve blando y friable, además denota que las paredes del órgano se encuentran hiperplásicas que con frecuencia ocasiona en los conductos biliares una afección de tipo crónico al hospedador que va acompañado de trastornos nutricionales en el animal, incluye malestar intestinal y dolor abdominal con presencia de cólico hepático.
La mayor cantidad de lesiones encontradas en los hígados de animales inspeccionados son de tipo aguda y crónica en consecuencia se presenta una fibrosis periductular, calcificación e hiperplasia de los ductos biliares. La presencia de fibrosis hepática esta correlacionada directamente con el incremento en el número de las formas adultas de Fasciola, ésta patología se la clasifica en tres estadios o fases; la primera presenta una afectación del área portal con cercanía a lesiones generadas a partir del parásito, pero el parénquima se encuentra intacto, en la etapa dos existe la presencia de daño del parénquima hepático y finalmente en la etapa tres existe la marcada separación entre los septos que conforman el tejido conectivo con una distribución a lo largo del parénquima hepático y la presencia de nódulos de regeneración.
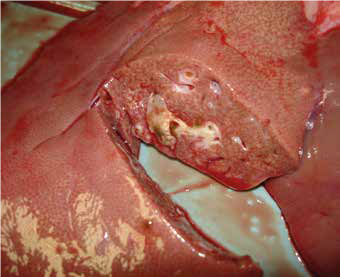
Daño En Hígado Por F Hepática
Una de las principales causas que originan la presencia de F. hepática, es el tratamiento incorrecto de heces que contaminan los pastos del lugar y contraen la infección al ser consumido por el animal, para ello es necesario mantener una limpieza continua de los zonas de pastoreo y sus alrededores, y así se logrará reducir el número de parásitos que provocan
esta enfermedad. Los programas de prevención son considerados más eficaces que los tratamientos farmacológicos aplicados en animales infectados, ya que de esta manera se evitará el contagio a animales sanos.
Para un correcto control de esta patología de una forma apropiada y segura se debe tomar medidas directamente hacia los tres factores principales que hacen que se desarrolle el ciclo de la F. hepática, los mismos que son: instalaciones, hospederos intermediarios (caracoles) y hospedero definitivo (animales de producción). Dentro de las medidas de prevención aplicadas en estos casos se encuentran las naturales o físicas tales como limpieza del lugar, control del tiempo de pastoreo del ganado, rotación de potreros, etc., que son aplicadas para prevenir la inoculación de este parásito y las medidas farmacológicas que son utilizadas en su mayoría para curar a aquellos animales que ya padecen de la enfermedad, medicamentos como el closantel oral (en caso de ovinos) y el clorsulón.
Otro factor que en escasas ocasiones se toma en cuenta, es el control del hospedero intermediario que es el caracol de género Lymnaea, para ello se debe considerar un control químico mediante la aplicación de molusquicidas.
El empleo de productos químicos como el sulfato de cobre en los potreros es poco efectivo y es ecológicamente cuestionable, ya que incrementa la contaminación ambiental, genera residuos que quedan en el agua y en el suelo y rompe el equilibrio biológico de la fauna presente en el suelo y en el agua. A su vez, la eliminación de las colonias de caracoles es muy difícil debido a su gran capacidad de reproducción y repoblación.
Aunado al control químico que debe ser considerado su uso ya que el impacto ambiental puede generar problemas, se debe recurrir también al control físico mediante el mejoramiento del drenaje.
Con estas medidas de control se intenta limitar o disminuir las poblaciones de caracoles a través de la reducción del hábitat propicio para el desarrollo de las colonias. Esto se logra mediante drenaje de áreas pantanosas, la limpieza de canales de riego, evitando el derrame permanente de los bebederos, etc.
El control de las parasitosis en las especies productivas debe ser orientado la prevención del contacto entre el parasito y los hospederos, se deben tomar acciones o medidas preventivas, tales como limpieza, conocimiento de las etapas productivas de cada animal, métodos biológicos como la rotación de potreros , antes de pensar en tratamientos farmacológicos o químicos. Estas medidas sanitarias no implican la solución al parasitismo, pero el conjunto de ellas nos ayuda a prevenir futuras infestaciones, aplicando siempre el principio de si previenes ganas.
Cabanelas, E., Díaz, P., Pérez, A., Remesar, S., Prieto, A., & Díaz, J. et al. (2017). Principales parasitosis del ganado ovino. Ovispain, 24, 25, 26. Retrieved from https://www.researchgate.net/publication/317727165_PRINCIPALES_PARASITOSIS_DEL_GANADO_OVINO
Hernández, A. (2011). ESTUDIO DE LA RESPUESTA INMUNE FRENTE A HAEMONCHUS CONTORTUS EN DOS RAZAS OVINAS CANARIAS (Doctorado). UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA FACULTAD DE VETERINARIA.
Larroza, M. (2019). Fasciolosis en ovinos: Recomendaciones para su control [Ebook] (pp. 29, 30). Argentina: INTA. Retrieved from https://www.researchgate.net/publication/334807491_FASCIOLOSIS_EN_OVINOS_RECOMENDACIONES_PARA_SU_CONTROL
López, I., Artieda, J., Mera, R., Muñóz, M., Rivera, V., & Cuadrado, A. et al. (2017). Fasciola hepática: aspectos relevantes en la salud animal. Selva Andina Animal Science, (4), 138,139,140,141. Retrieved from http://www.scielo.org.bo/pdf/jsaas/v4n2/v4n2_a06.pdf
Olaechea, F. (2007). Fasciola hepática en ovinos [Ebook] (pp. 4,8). Argentina: INTA. Retrieved from https://inta.gob.ar/sites/defa...